BON USAGE 1
Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients
Interactions

*par ex. certains antiviraux (par ex. indinavir, nelfinavir, ritonavir, saquinavir), antibiotiques macrolides (par ex. clarithromycine, télithromycine, troléandomycine), antifongiques (par ex. kétoconazole, voriconazole), la néfadozone, le pamplemousse et le jus de pamplemousse.
**par ex. diltiazepam et vérapamil. ***par ex. gemfibrozil. °par ex. rifampicine, carbamazépine, phénytoïne, rifabutine, phénobarbital et millepertuis. °°par ex. éfavirenz, modafinil, bosentan, étravirine et nafcilline. #par ex. alfentanil, fentanyl, quinidine, ciclosporine, sirolimus, tacrolimus. ##par ex. digoxine, dabigatran, colchicine, pravastatine. ###par ex. méthotrexate, rosuvastatine, sulfasalazine.
Grossesse, allaitement et fertilité
Populations particulières 1

Pour plus d’informations, se reporter au Résumé des Caractéristiques du produit ALUNBRIG®.
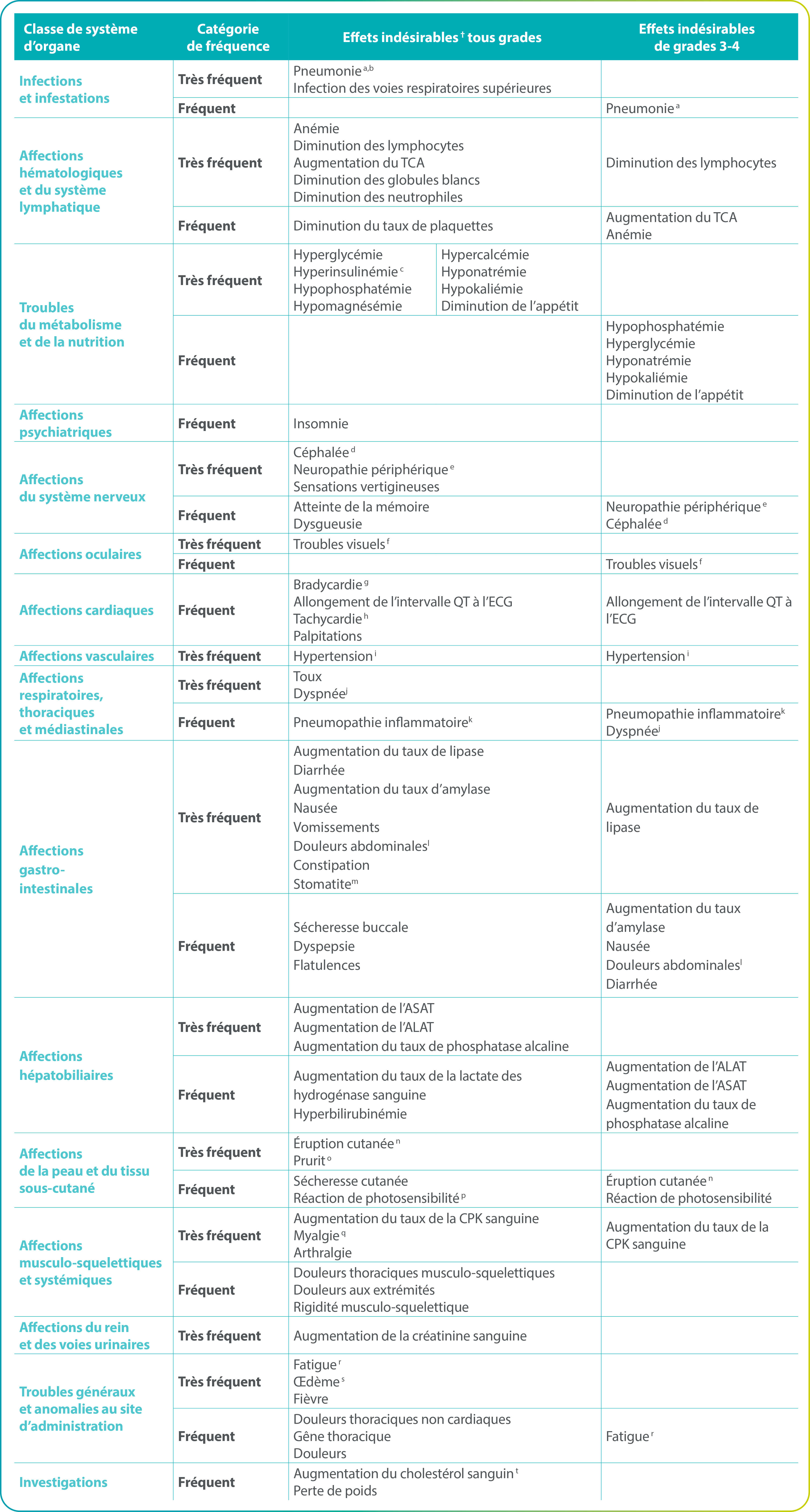
Effets indésirables
Les effets indésirables rapportés sont présentés dans le tableau suivant par classe de système d’organe, terme préférentiel et fréquence. Les catégories de fréquence sont : très fréquent (≥ 1/10) et fréquent (≥ 1/100 à < 1/10).
Déclarez immédiatement tout effet indésirable suspecté d’être dû à un médicament à votre Centre régional de pharmacovigilance (CRPV) ou sur https://signalement.social-sante.gouv.fr.
Pour plus d’informations sur les effets indésirables peu fréquents ou rares,
se reporter au Résumé des Caractéristiques du produit ALUNBRIG®
- Inclus : pneumonie atypique, pneumonie, pneumonie d’inhalation, pneumonie à cryptocoque, infection des voies respiratoires inférieures, infection virale des voies respiratoires inférieures, infection pulmonaire
- Inclus les événements de grade 5
- Grade non applicable
- Inclus : céphalée, céphalée d’origine sinusale, gêne au niveau de la tête, migraine, céphalée de tension
- Inclus : paresthésies, neuropathie sensorielle périphérique, dysesthésie, hyperesthésie, hypoesthésie, névralgie, neuropathie périphérique, neurotoxicité, neuropathie motrice périphérique, polyneuropathie, sensation de brûlure, névralgie post-herpétique
- Inclus : perception visuelle de la profondeur altérée, cataracte, daltonisme acquis, diplopie, glaucome, augmentation de la pression intra-oculaire, œdème maculaire, photophobie, photopsie, œdème rétinien, vision trouble, baisse de l’acuité visuelle, défaut du champ visuel, décollement du vitré, corps flottants vitréens, amaurose fugace
- Inclus : bradycardie, bradycardie sinusale
- Inclus : tachycardie sinusale, tachycardie, tachycardie auriculaire, augmentation de la fréquence cardiaque
- Inclus : augmentation de la pression artérielle, hypertension diastolique, hypertension, hypertension systolique
- Inclus : dyspnée, dyspnée d’effort
- Inclus : pneumopathie interstitielle diffuse, pneumopathie inflammatoire
- Inclus : gêne abdominale, distension abdominale, douleur abdominale, douleur abdominale basse, douleur abdominale haute, inconfort épigastrique
- Inclus : stomatite aphteuse, stomatite, ulcère aphteux, ulcération buccale, vésicules buccales
- nclus : dermatite acnéiforme, érythème, éruption cutanée exfoliative, éruption cutanée, éruption cutanée érythémateuse, éruption cutanée maculaire, éruption cutanée maculo-papulaire, éruption cutanée papulaire, éruption cutanée pruritique, éruption cutanée pustulaire, dermatite, dermatite allergique, dermatite de contact, érythème généralisé, éruption cutanée folliculaire, urticaire, éruption médicamenteuse, éruption cutanée toxique
- Inclus : prurit, prurit allergique, prurit généralisé, prurit génital, prurit vulvo-vaginal
- Inclus : réaction de photosensibilité, lucite polymorphe, dermatite solaire
- I nclus : douleurs musculo-squelettiques, myalgie, spasmes musculaires, rigidité musculaire, contractions musculaires, gêne musculo-squelettique
- Inclus : asthénie, fatigue
- Inclus : œdème de la paupière, œdème de la face, œdème périphérique, œdème péri-orbitaire, gonflement du visage, œdème généralisé, gonflement périphérique, angio-œdème, gonflement des lèvres, gonflement périorbitaire, gonflement de la peau, gonflement des paupières
- Inclus : augmentation du cholestérol sanguin, hypercholestérolémie
Mises en garde et précautions d’emploi
Pour plus d’informations, se reporter au Résumé des Caractéristiques du produit ALUNBRIG®.












