Données d’efficacité cliniques pour vos patients CBNPC ALK+
L’ANALYSE FINALE DE L’ÉTUDE DE PHASE III MENÉE
POUR VOS PATIENTS CBNPC ALK+
Méthodologie 3
Étude internationale (20 pays), de phase III,
randomisée, en ouvert, multicentrique (124 centres)
Objectif de l’étude
Évaluer l’efficacité et la tolérance d’ALUNBRIG® par rapport au crizotinib chez des patients atteints d’un CBNPC avancé ALK+ non préalablement traités par un inhibiteur d’ALK.
Design de l’étude
Stratification selon :
- La présence de métastases cérébrales (présence vs absence)
- L’administration antérieure d’une chimiothérapie dans un contexte de maladie localement avancée ou métastatique (oui vs non)
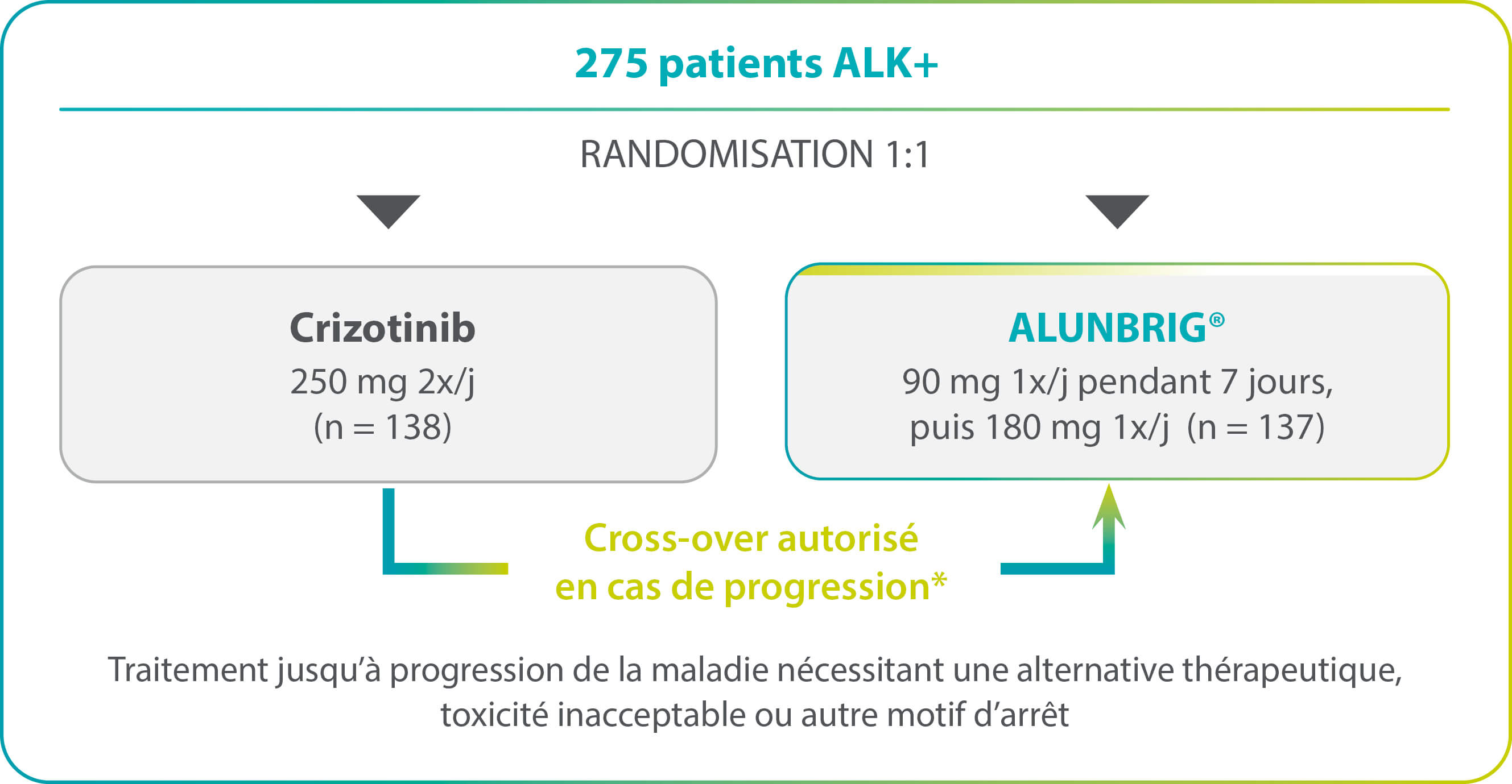

* 10 jours de wash-out avant admission dans le bras ALUNBRIG©.
Critère d’évaluation principal
Survie sans progression (SSP) évaluée en aveugle par un comité de revue indépendant (CRI) selon les critères RECIST v1.1
Principaux critères d’évaluation secondaires
- Taux de réponse objective (TRO) confirmée, évaluée par le CRI*
- Durée de la réponse (DR), évaluée par le CRI
- Taux de réponse objective intracrânienne (TROic) confirmée, évaluée par le CRI*
- Durée de réponse intracrânienne
- Survie sans progression intracrânienne (SSPic)**, évaluée par le CRI*
- Survie globale (SG)*
- Délai jusqu’à la réponse, évalué par le CRI
- Qualité de vie : variation du score d’état de santé global et de qualité de vie par rapport à l’inclusion
- Tolérance
Deux analyses intermédiaires ont été planifiées à 50 % et à 75 % de la survenue totale des évènements attendus (progression ou décès).
* Ces 4 critères secondaires (TRO, TROic, SSPic, SG) ont fait l’objetd’une analyse hiérarchique séquentielle. ** Définie par la durée entre la date de randomisation et la date de progression intracrânienne, de décès ou de radiothérapie pour le traitement d’une métastase cérébrale chez les patients ayant des métastases cérébrales à l’inclusion.
Principaux critères d’inclusion
- Âge ≥ 18 ans
- CBNPC localement avancé ou métastatique ayant au moinsune lésion mesurable selon les critères RECIST v1.1
- Réarrangement ALK+ confirmé
- Score de performance ECOG ≤ 2
- Patients n’ayant reçu aucun autre inhibiteur d’ALK
Principaux critères d’exclusion
- Plus d’une chimiothérapie dans un contexte de maladie localement avancée ou métastatique
- Chimiothérapie ou radiothérapie dans les 14 jours avant la première dose de médicament de l’essai
- Patients ayant des antécédents de maladie pulmonaire interstitielle diffuse, de pneumopathie inflammatoire médicamenteuse ou de pneumopathie radique
- Métastases symptomatiques du système nerveux central (parenchymateuses ou leptoméningées) au recrutement

CBNPC : cancer bronchique non à petites cellules.
# Médiane de suivi : ALUNBRIG® : 40,4 mois et crizotinib : 15,2 mois.
L’ANALYSE FINALE DE L’ÉTUDE DE PHASE III MENÉE
POUR VOS PATIENTS CBNPC ALK+
Résultats 3
Caractéristiques des patients équilibrées entre les 2 bras*
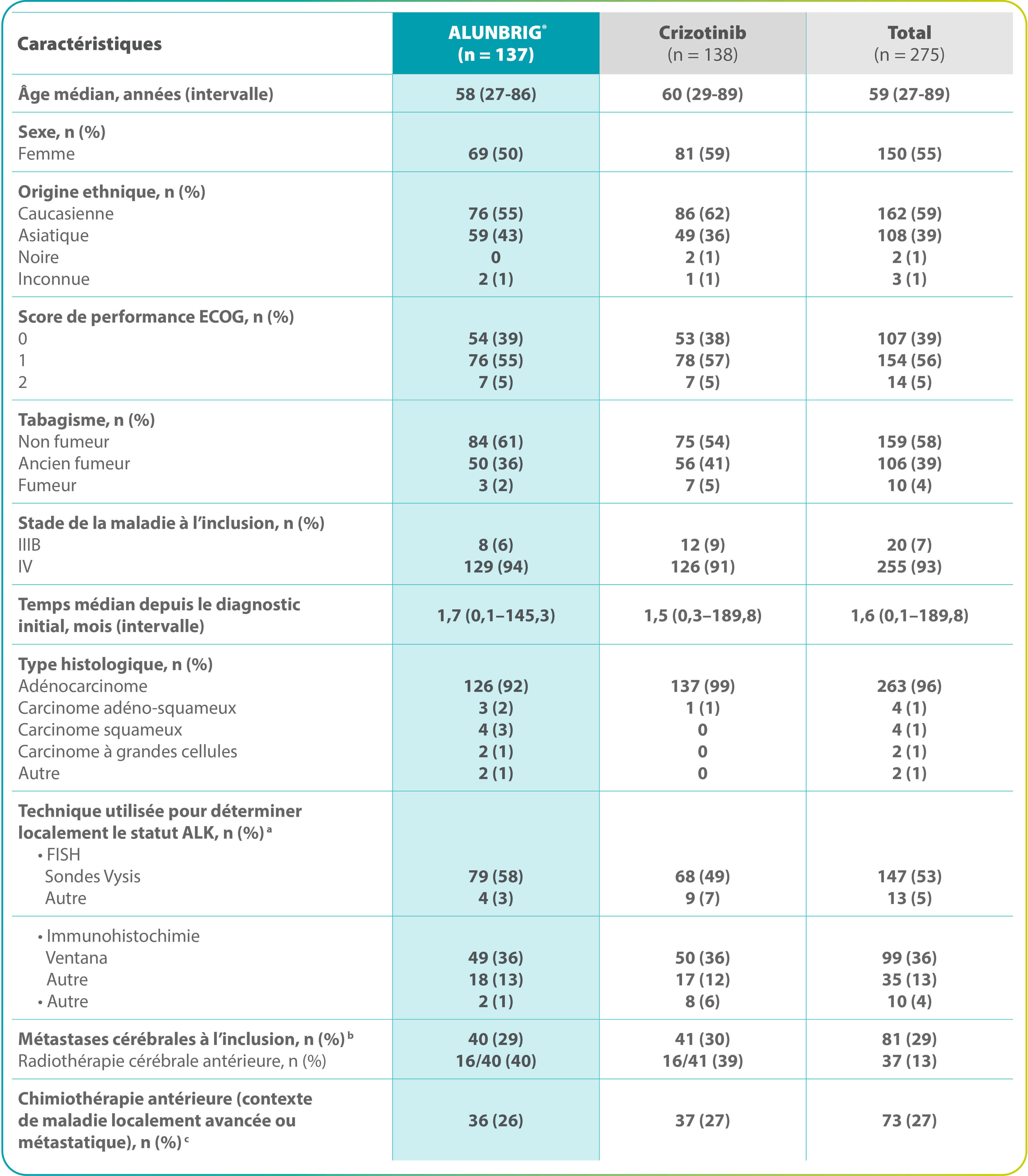
ALK : kinase du lymphome anaplasique ; ECOG : Eastern Cooperative Oncology Group ; FISH : hybridation in situ en fluorescence.
* La somme des pourcentages n’est pas égale à 100 à cause des arrondis. a Statut ALK+ confirmé par 1 ou plusieurs techniques. b D’après l’évaluation de l’investigateur. c La chimiothérapie antérieure a été définie comme l’achèvement d’au moins 1 cycle entier de chimiothérapie dans le contexte de maladie localement avancée ou métastatique.

UNE RÉDUCTION DU RISQUE DE PROGRESSION
OU DE DÉCÈS POUR VOS PATIENTS 3
Survie sans progression
(évaluation en aveugle par le comité de revue indépendant)
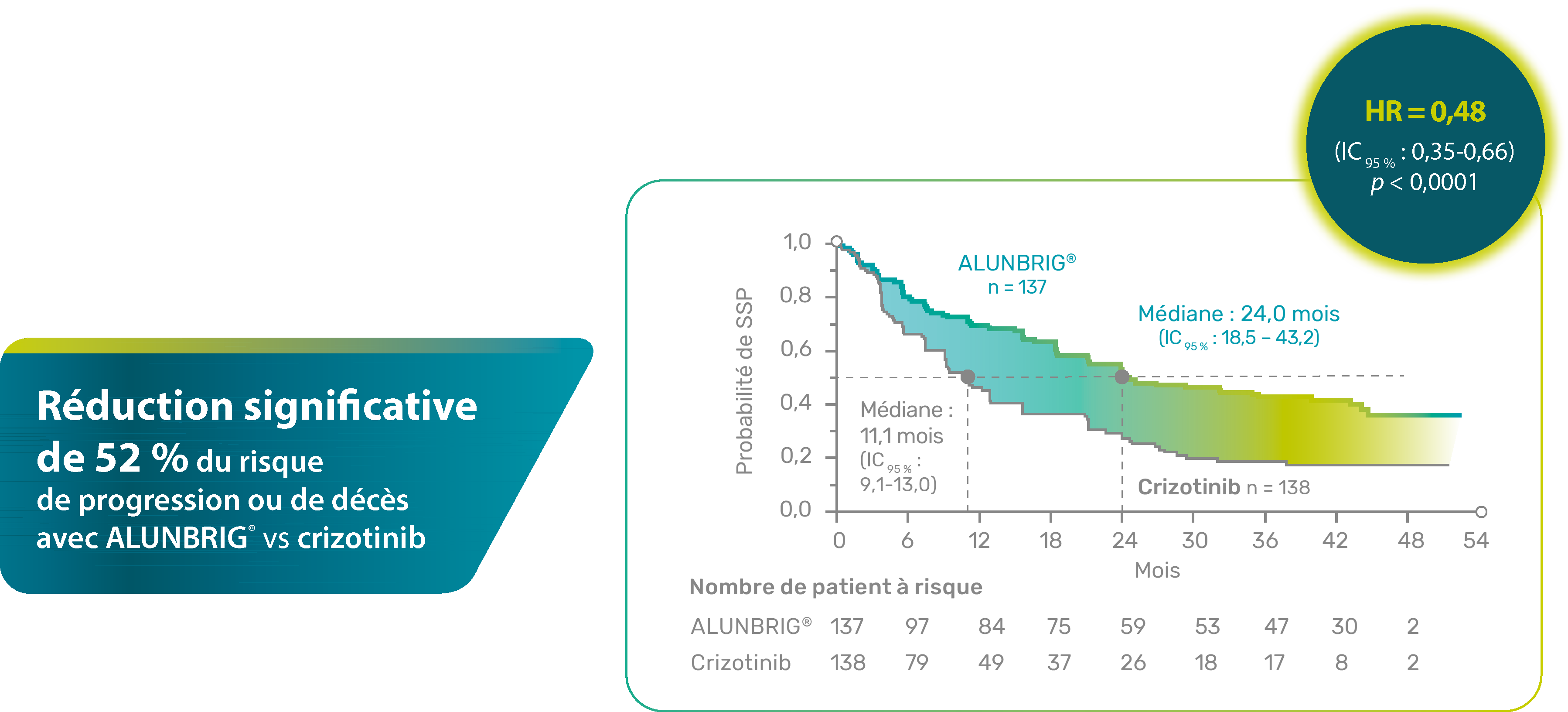


Survenue d’un évènement (progression, décès ou radiothérapie palliative) chez 53 % des patients traités par ALUNBRIG® et 67 % des patients traités par crizotinib
* Métastases cérébrales à l’inclusion évaluées par l’investigateur.
HR : hazard ratio ; IC : indice de confiance ; ITT : intention de traiter ; SSP : survie sans progression.
Survie sans progression : analyse en sous-groupes 3,4
(évaluation en aveugle par le comité de revue indépendant)
L’analyse en sous-groupes du critère principal était prévue dans le protocole de l’étude clinique et était stratifiée selon la présence de métastases cérébrales à l’inclusion et l’administration d’un traitement antérieur par chimiothérapie.
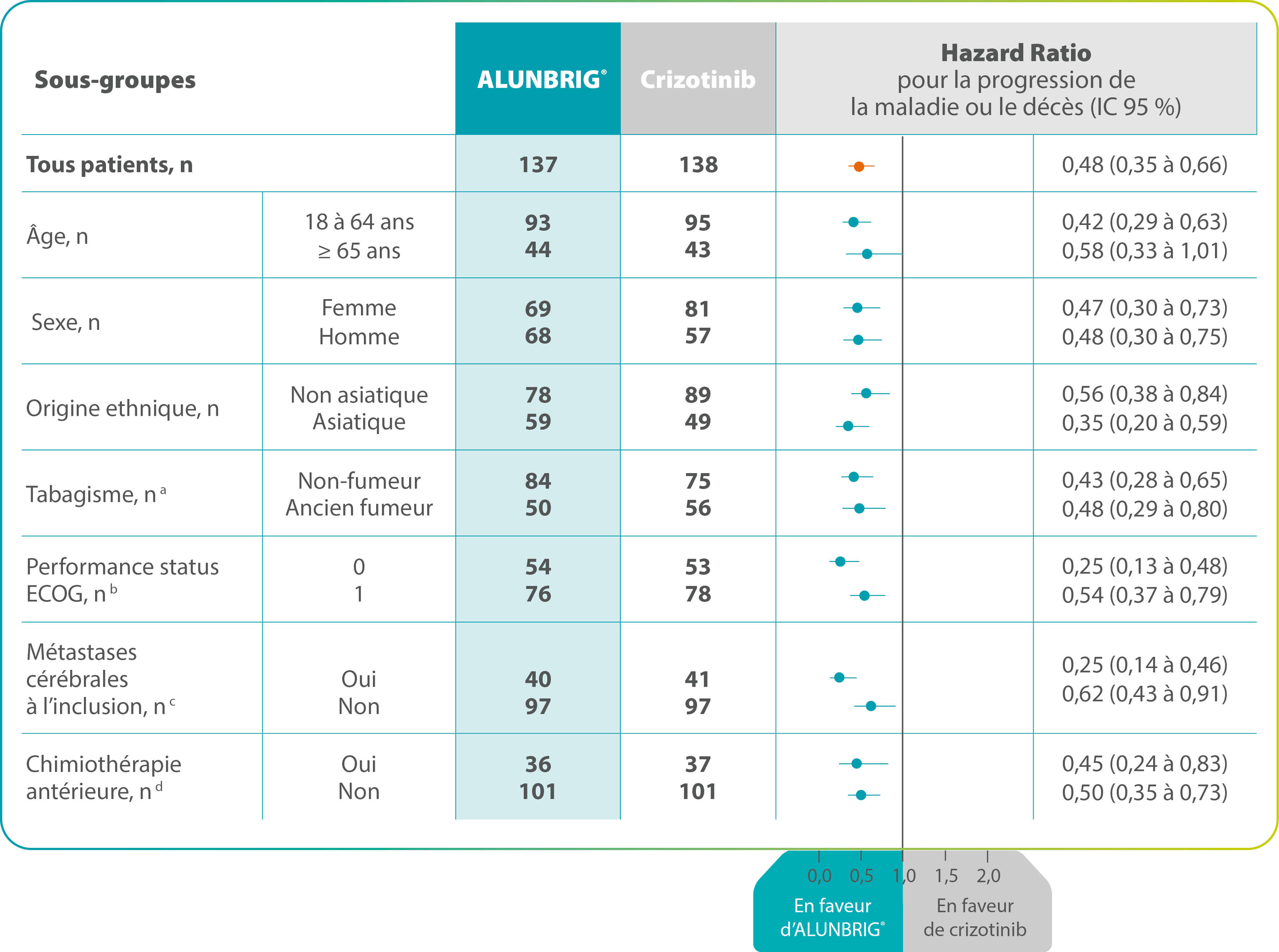
Il n’y a pas eu d’effets néfastes observés chez les patients quels que soient l’âge avancé (≥ 65 ans), le sexe, l’origine ethnique, le statut tabagique ou l’indice de performance ECOG. 4
IC : Intervalle de Confiance ; ECOG : Eastern Cooperative Oncology Group.
- a Hazard ratio non calculé en raison du nombre insuffisants de patients actuellement fumeurs (ALUNBRIG®, n = 3 ; crizotinib, n = 7).
- b Hazard ratio non calculé en raison du nombre insuffisants de patients avec un statut EGOG égal à 2 (ALUNBRIG®, n = 7 ; crizotinib, n = 7).
- c Métastases cérébrales à l’inclusion évaluées par l’investigateur.
- d Chimiothérapie antérieure pour maladie localement avancée ou métastatique.

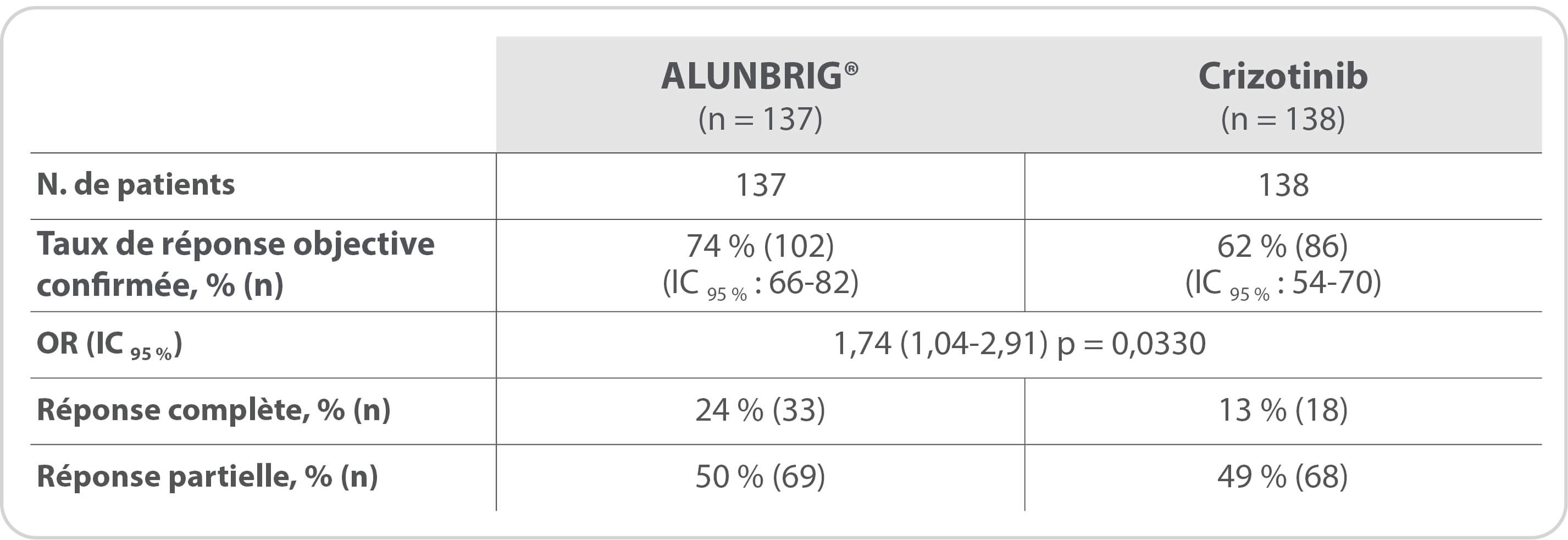
Selon l’analyse hiérarchisée réalisée, le premier critère secondaire de l’étude : Taux de réponse objective confirmée, n’étant pas significatif lors de la 1ère analyse intermédiaire, tous les critères secondaires suivants sont présentés à titre exploratoire.
PLACE DANS LA STRATÉGIE THÉRAPEUTIQUE 2 :
Sa supériorité par rapport au crizotinib a été démontrée uniquement en termes de survie sans progression. En l’absence de donnée comparative, sa place vis-à-vis de l’alectinib reste à préciser. Toutefois, le choix d’un anti-ALK en première ligne doit prendre en compte le niveau de démonstration de chaque molécule et son profil de tolérance. Dans ce contexte, l’alectinib a démontré un effet sur les métastases cérébrales. Par ailleurs, les conditions d’utilisation peuvent être discutées en cas de sensibilité de la mutation à la molécule (tel que déterminé par phénotypage des mécanismes de résistance par « biopsie liquide » ou prélèvement in situ), et en option après considération du rapport bénéfice/tolérance dans les autres cas.
Taux de réponse objective confirmée
(évaluation par le comité de revue indépendant)

Durée médiane de réponse confirmée
(évaluation par le comité de revue indépendant ; résultat présenté à titre exploratoire)
Délai jusqu’à la réponse chez les patients répondeurs
(évaluation par le comité de revue indépendant)
ALUNBRIG® (n = 137)
Patients répondeurs : n = 102
Délai jusqu’à la réponse (médiane) :
1,84 mois
(IC 95 % : 1,84‑1,87)
Crizotinib (n = 138)
Patients répondeurs : n = 86
Délai jusqu’à la réponse (médiane) :
1,87 mois
(IC 95 % : 1,84‑1,87)
Survie globale
ALUNBRIG® : non atteinte (IC 95 % : NA-NA)
Crizotinib : non atteinte (IC95 % : NA-NA)
HR = 0,81 (IC 95 % : 0,53 – 1,22) ; p = 0,331
Selon l’analyse de sensibilité, le hazard ratio de la survie globale, après ajustement sur l’effet du cross-over, était de 0,54 (IC 95 % : 0,31-0,92, p = 0,023) par la méthode MSM, et de 0,50 (IC 95 % : 0,28–0,87 ; p = 0,014) par la méthode IPCW.
HR : hazard ratio ; IPCW : Inverse probability of censoring weighting ; ITT : intention de traiter ; MSM : Marginal structural approach ; NE : non évaluable ; NA : non atteint ; OR : odds ratio ; SSP : survie sans progression.

Selon l’analyse hiérarchisée réalisée, le premier critère secondaire de l’étude : Taux de réponse objective confirmée, n’étant pas significatif lors de la 1ère analyse intermédiaire, tous les critères secondaires suivants sont présentés à titre exploratoire.
PLACE DANS LA STRATÉGIE THÉRAPEUTIQUE 2 :
Sa supériorité par rapport au crizotinib a été démontrée uniquement en termes de survie sans progression. En l’absence de donnée comparative, sa place vis-à-vis de l’alectinib reste à préciser. Toutefois, le choix d’un anti-ALK en première ligne doit prendre en compte le niveau de démonstration de chaque molécule et son profil de tolérance. Dans ce contexte, l’alectinib a démontré un effet sur les métastases cérébrales. Par ailleurs, les conditions d’utilisation peuvent être discutées en cas de sensibilité de la mutation à la molécule (tel que déterminé par phénotypage des mécanismes de résistance par « biopsie liquide » ou prélèvement in situ), et en option après considération du rapport bénéfice/tolérance dans les autres cas.
Durée médiane de réponse intracrânienne chez les patients répondeurs
(évaluation par le comité de revue indépendant)
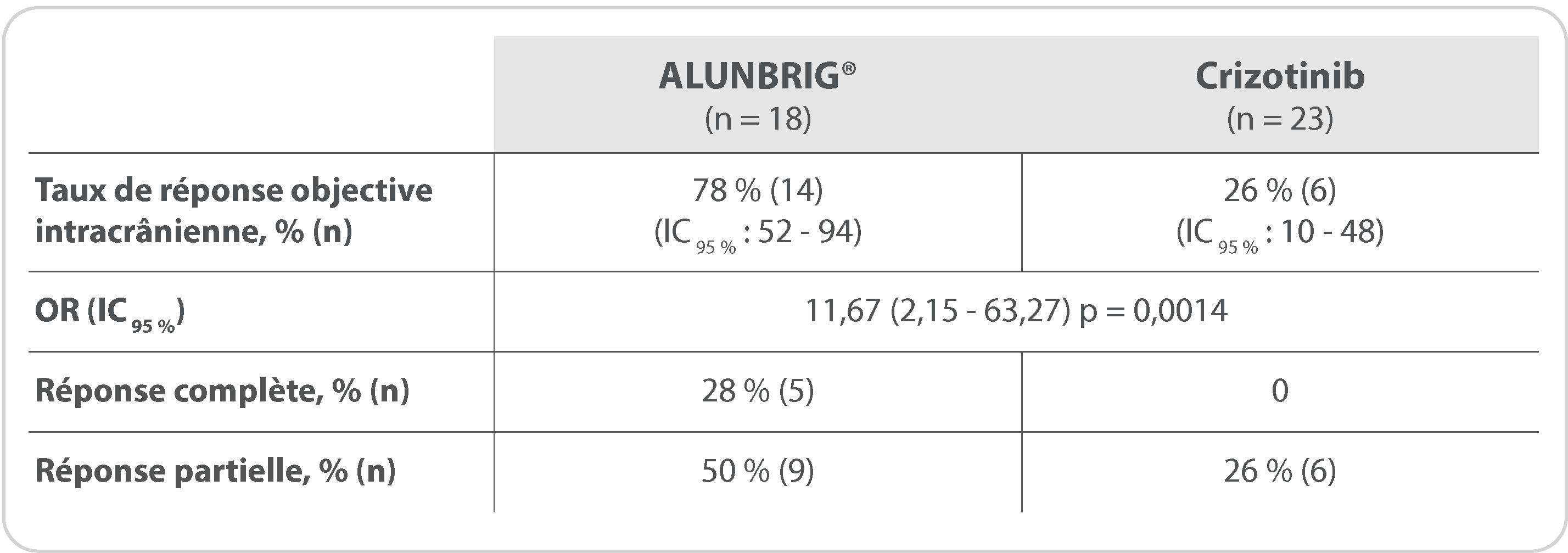
Taux de réponse objective intracrânienne confirmée
(évaluation par le comité de revue indépendant)

Taux de réponse objective intracrânienne confirmée
(évaluation par le comité de revue indépendant)
Durée médiane de réponse intracrânienne chez les patients répondeurs
(évaluation par le comité de revue indépendant)
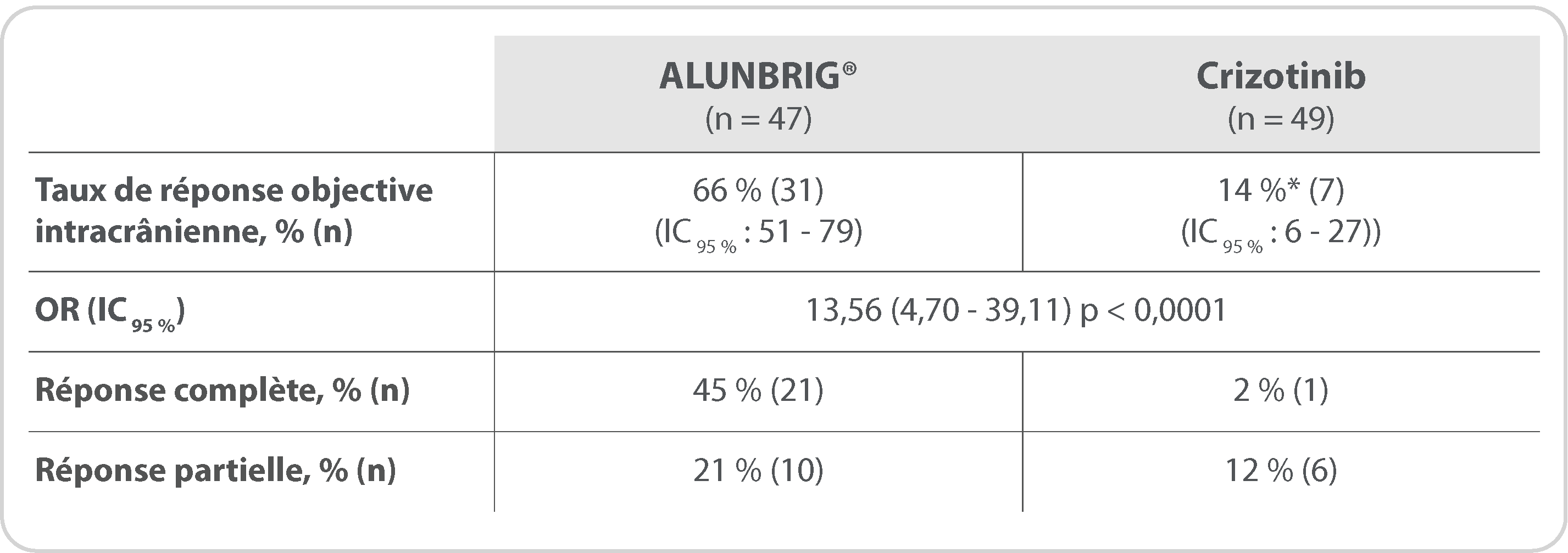
Survie sans progression intracrânienne chez les patients avec métastases cérébrales à l’inclusion
(évaluation par le comité de revue indépendant)
ALUNBRIG® (n = 47)
24 mois
(IC 95 % : 12,9‑30,8)
Crizotinib (n = 49)
5,5 mois
(IC 95 % : 3,7‑7,5)
HR = 0,29 (IC 95 % : 0,17–0,51) ; p < 0,0001
NE : non évaluable ; OR : odds ratio
* La différence de taux réponse complète par rapport à la seconde analyse intermédiaire est due à une reclassification de la réponse chez l’un des patients ayant reçu un traitement anticancéreux ultérieur avant qu’une réponse complète ne soit observée.
![]()
DES RÉSULTATS DE TOLÉRANCE DOCUMENTÉS
POUR VOS PATIENTS 3
Évènements indésirables les plus courants, tous grades confondus (> 25% des patients)
Symptômes
gastro-intestinaux
Augmentation
du taux de CPK
dans le sang
Toux
Augmentation
du taux des
ALAT/ASAT
ALAT : alanine aminotransférase ; ASAT : aspartate aminotransférase ; CPK : créatine phosphokinase ; ITT : intention de traiter.
Effets indésirables rapportés chez ≥ 5 % des patients, tous grades confondus
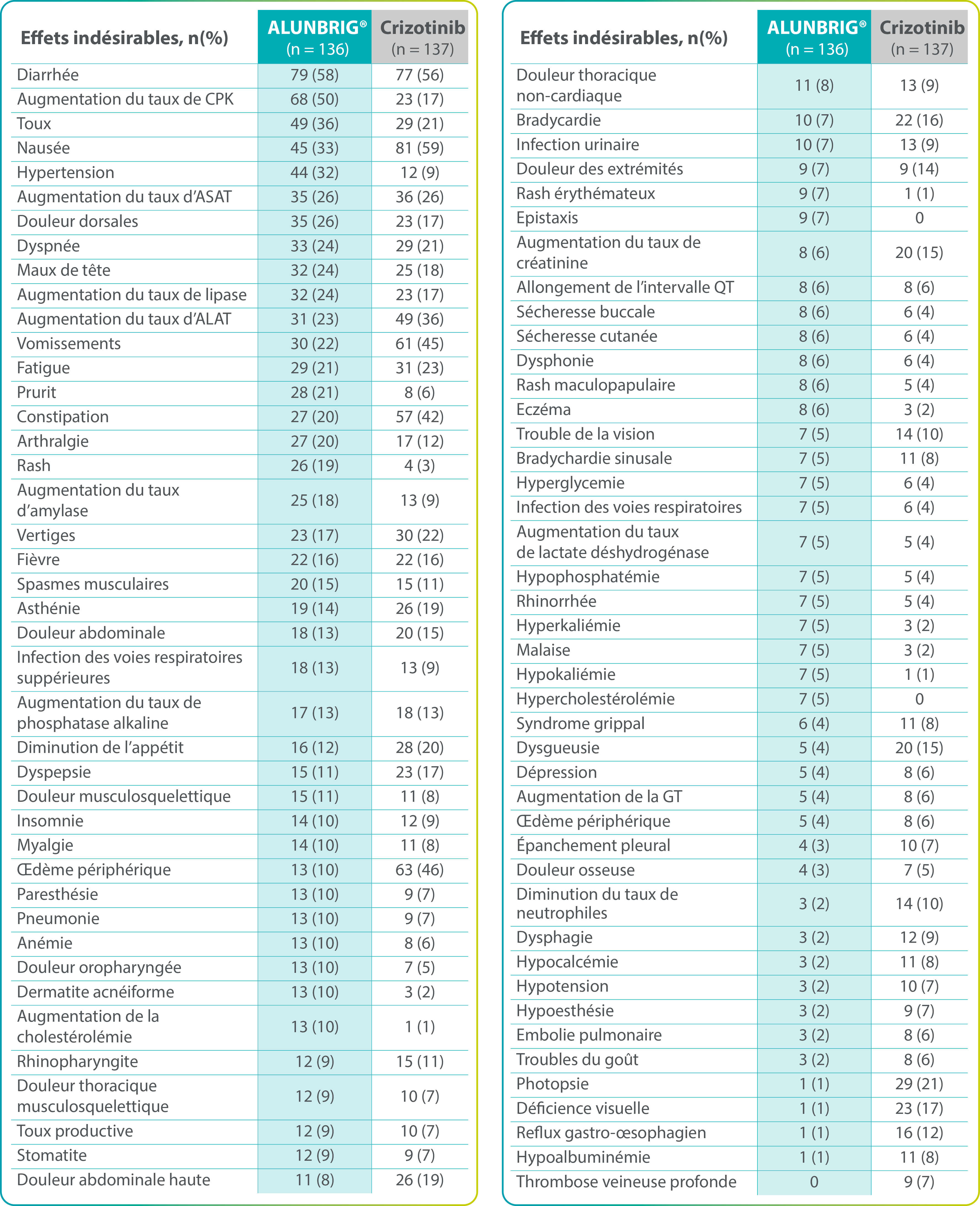
ALAT : alanine aminotransférase ; ASAT : aspartate aminotransférase ; CPK : créatine phosphokinase ; ITT : intention de traiter.
Effets indésirables de grade ≥ 3 rapportés chez ≥ 2 % des patients de l’un des groupes
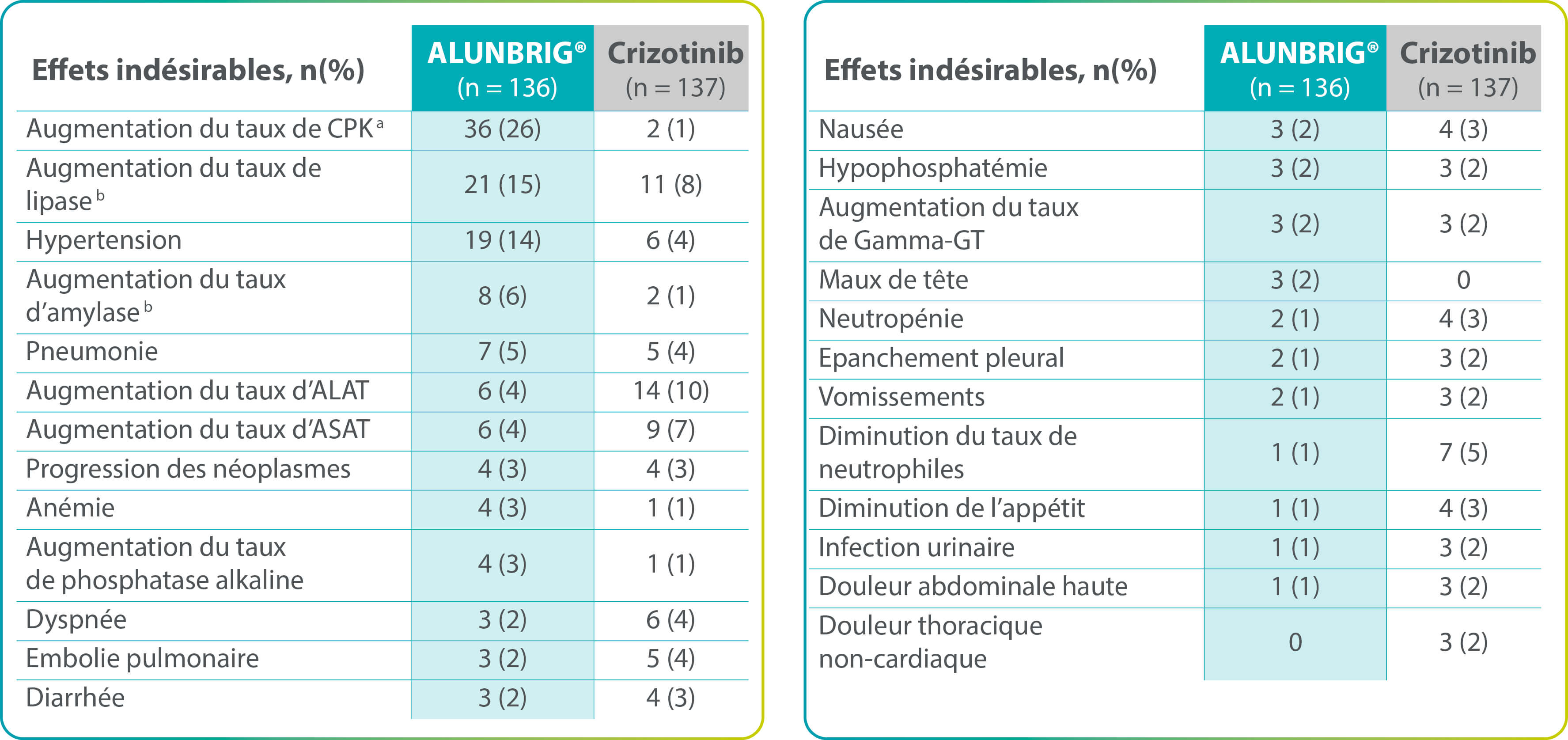
ALAT : alanine aminotransférase ; ASAT : aspartate aminotransférase ; CPK : créatine phosphokinase ; Gamma-GT : gamma-glutamyl transférase ; ITT : intention de traiter
a Des myalgies ont été rapportées chez 14 (10 %) et 11 (8 %) patients dans les bras ALUNBRIG® et crizotinib, respectivement. Des douleurs musculo-squelettiques ont été signalées chez 15 (11 %) et 11 (8 %) patients, respectivement. Aucune myalgie ou douleur musculo-squelettique de grade ≥ 3 n’a été signalée dans les deux bras. b Aucun cas de pancréatite clinique n’a été signalé dans les deux bras.

Événements pulmonaires (pneumopathie interstitielle
diffuse (PID)/pneumopathie inflammatoire)
FRÉQUENCE :
- à tout moment : ALUNBRIG® 6 % (8/136) vs crizotinib 2 % (3/137)
- grade 3 ou 4 : ALUNBRIG® 3 % (4/136) vs crizotinib 1/137 (<1 %)
- après cross-over du bras crizotinib au bras ALUNBRIG® : 6 % (4/65)
Réduction de dose
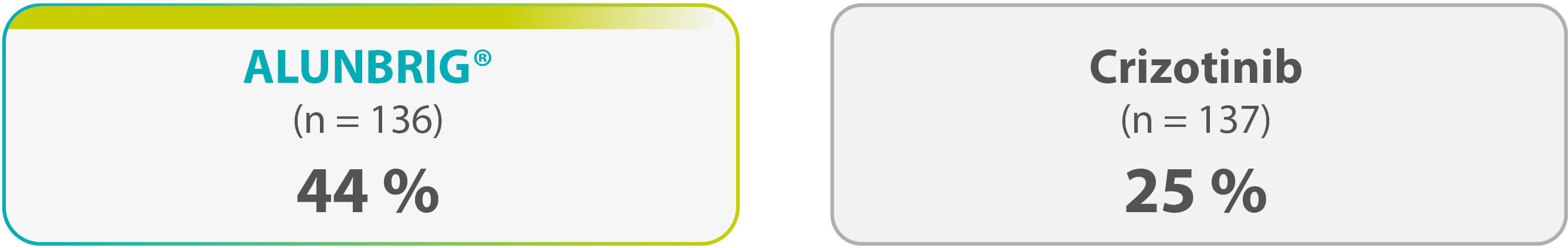
... des patients ont eu recours à une réduction de dose en raison d’événements indésirables.
Les évènements indésirables ayant conduits le plus fréquemment à une réduction de dose sont des anomalies de paramètres de laboratoire (augmentation du taux de CPK : 18 %, augmentation du taux de lipase : 7 %, augmentation du taux d’amylase : 4 %) puis l’hypertension (3 %). Les autres EIs sont survenus avec une occurence ≤ 2 %.
Arrêt de traitement
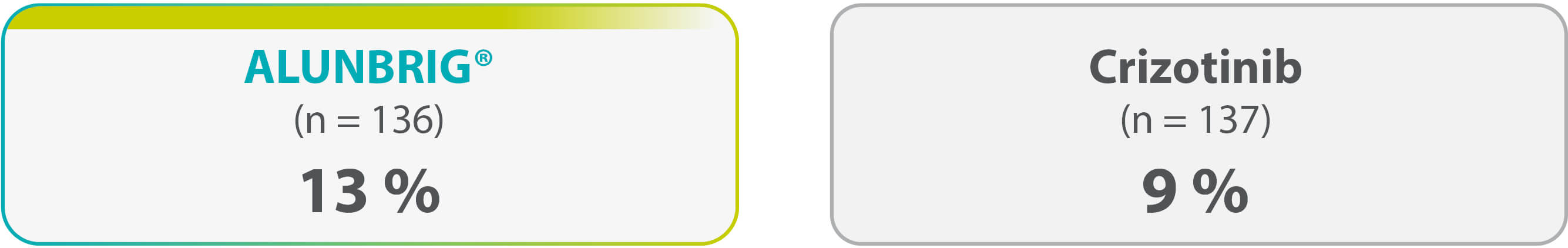
... des patients ont arrêté définitivement le traitement en raison d’événements indésirables.
ITT : intention de traiter
